
- 职称:
- 职务:主任,高级研究员
- 研究领域:电生理学、磁共振成像、计算神经科学、系统神经科学、视觉感知、物体识别、神经血管耦合、学习与记忆
- 电话:
- 邮箱:nikos.logothetis@icpbr.ac.cn
尼克劳斯·罗戈塞提斯(Nikos K. Logothetis)现任中国上海国际灵长类脑研究中心(ICPBR)联合主任(蒲慕明院士同为中心联合主任)。自2022年1月1日起,他还担任德国图宾根马克斯·普朗克生物控制论研究所(MPI-BC)名誉所长,以及英国曼彻斯特维多利亚大学(VUoM)名誉兼职教授。
他曾在雅典大学获得数学学士学位和塞萨洛尼基大学获得生物学学士学位。他在雅典希腊音乐学院学习钢琴,并在慕尼黑路德维希·马克西米利安大学获得人类神经生物学博士学位。1985年,他进入麻省理工学院(MIT)脑与认知科学系,最初作为博士后研究员,后期担任研究科学家。
1990年,罗戈塞提斯(Logothetis)加入贝勒医学院神经科学系任教,七年后他被选为马克斯·普朗克生物控制论研究所(MPI-BC)所长,继续从事系统神经科学研究,包括视觉认知、听觉感知和多感觉整合的生理机制研究,以及非人类灵长类动物(NHP)的可塑性和神经调节研究。与此同时,他还开发了多种技术,将电生理学、直接电刺激或光刺激和药理学与结构和功能磁共振成像(fMRI)相结合。这种全新的多学科方法允许同时研究非人类灵长类动物(NHP)的单个神经元、微电路和神经回路。
除了在德国和英国的主要工作经历外,罗戈塞提斯(Logothetis)自1992年起,担任圣地亚哥索尔克研究所神经生物学兼职教授;自1995年起,担任休斯顿贝勒医学院眼科兼职教授、圣地亚哥神经科学研究所副教授、伦敦大学学院高级客座研究员、马萨诸塞州波士顿大学认知与神经系统系兼职教授;自2018年起,担任希腊雅典医科大学兼职教授。他还被选为美国斯坦福大学神经科学客座教授。
他获得过多项奖项,包括1996年DeBakey科学卓越奖、1999年Minerva基金会金脑奖、2003年Louis-Jeantet医学奖、2004年Zülch神经科学奖、2007年IPSEN神经元可塑性奖、2008年纽约哥伦比亚大学Alden Spencer奖,以及2016年雅典学院Aristeion奖。他被选为多家科学院院士,包括德国利奥波第那科学院院士、罗丹科学院院士、美国艺术与科学院荣誉院士、美国国家科学院外籍院士。
他曾担任美国麻省理工学院(MIT)麦戈文研究所、麻省理工学院脑与认知科学、芬兰赫尔辛基科学院系统神经科学卓越中心、德国美茵河畔法兰克福脑成像中心、法国巴黎ICM-ADREC、以色列耶路撒冷希伯来大学大脑中心、以色列耶路撒冷魏茨曼研究所脑研究中心、以及中国科学院神经科学研究所(CAS)和位于中国上海的中国科学院脑科学与智能技术卓越创新中心(CEBSIT)的顾问委员会成员。
他曾担任《欧洲神经科学杂志》(EJN)收稿编辑、《认知科学趋势》(TICS)、《神经元》、《当代生物学》(Current Biology)、《当代神经生物学观点》(Current Opinion Neurobiology,)副主编,并且是《自然》(Nature)、《自然神经学》(Nature Neuroscience)、《神经科学杂志》(J Neuroscience)、《美国国家科学院院刊》(PNAS)、《大脑皮层》(Cerebral Cortex)、《脑血流量与代谢》(Cerebral Blood Flow and Metabolism)、《神经生理学杂志》(Journal of Neurophysiology)、《实验脑研究》(Experimental Brain Research)和《视觉研究》(Vision Research)定期审稿人。
他是美国神经科学学会、欧洲神经科学协会、美国科学促进会、视觉与眼科研究协会、纽约科学院、工业与应用数学学会、美国数学学会、国际神经心理学会和美国数学协会成员。
荣誉与奖项
2019年 希腊雅典国立卡波季斯特里亚大学杰出荣誉教授和博士学位奖
2016年 希腊雅典 雅典学院奖
2014年 美国纽约 首届 Rodolfo Llinás讲座
2013年 美国纽约西蒙斯基金会主题讲座
2012年 美国新奥尔良SfN特别讲座
2012年 西班牙圣塞巴斯蒂安SNL主题讲座
2012年美国费城生物精神病学协会主题讲座
2011年美国芝加哥大学S.J.卡尔森特别讲座
2011年 美国新泽西州罗格斯大学Julesz开幕讲座
2011年 美国达勒姆杜克大学Ruth Broad 讲座
2009年 美国华盛顿国家科学院外籍院士
2008年 美国纽约哥伦比亚大学神经生物学和行为中心Alden Spencer奖
2008年 美国坎布里奇美国艺术与科学院外籍荣誉院士
2007年 英国剑桥阿德里安神经科学年度讲座
2007年 澳大利亚墨尔本IPSEN 基金会神经元可塑性奖(IBRO)
2006年 牛津大学谢林顿百年讲座
2006年 哥本哈根大学年度主题身心讲座
2005年 德国国家科学院Leopoldina院士
2005年 加拿大哈利法克斯草地讲座
2005年 日本神经科学会议主题讲座
2004年 Joachim H. Zülch奖
2004年 蒙特利尔神经学研究所托马斯·威利斯(Thomas Willis)讲座
2004年 葡萄牙里斯本FENS主席讲座
2004年 法国巴黎科学院院士
2004年 巴西圣保罗主题讲座
2004年 英国伦敦英国心理学会主题讲座
2003年 Louis-Jeantet医学奖
2003年 美国新奥尔良SFN主席讲座(辉瑞)
2002年 荷兰奈梅亨F.C. Donders讲座,
2001年 英国布莱顿人脑图谱组织OHBM主题讲座
2000年 美国圣安东尼奥OHBM主题讲座
1999年 以色列耶路撒冷国际神经科学学会主题讲座
1999年 密涅瓦基金会金脑奖
1996年 荣获德贝基杰出科学奖
1994年 麦克奈特奖
1987年 Fairchild奖学金
1981年 德国DAAD研究生奖学金
2000年至2021年期间Logothetis系校友
MPI-BC以下博士后研究员目前都是成功的研究科学家,其中大多数是欧洲、俄罗斯、中国和美国大学的教授。
1. Alexander Ecker - 德国哥廷根乔治奥古斯特大学
2. Alexander Maier - 美国田纳西州纳什维尔的范德堡大学
3. Amir Shmuel - 加拿大蒙特利尔的麦吉尔大学神经科学研究所(MNI)
4. Andreas Bartels - 德国蒂宾根大学整合神经科学中心
5. Andreas Tolias - 美国德克萨斯州休斯顿的贝勒医学院
6. Asif Ghazanfar - 美国新泽西州普林斯顿大学
7. Bruno Weber - 瑞士苏黎世联邦理工学院
8. Christoph Kayser - 英国格拉斯哥大学
9. Christos Konstantinos - 美国凯斯西储大学
10. Chris Petkov - 英国纽卡斯尔泰恩河畔纽卡斯尔大学医学院
11. Christoph Juchem – 美国耶鲁大学
12. David Leopold - 美国马里兰州贝塞斯达的国家精神卫生研究所(NIMH)
13. David Omer - 以色列耶路撒冷希伯来大学
14. David Sheinberg - 美国罗德岛普罗维登斯的布朗大学
15. George Keliris – 比利时安特卫普大学
16. Gregor Rainer - 瑞士弗里堡大学
17. Goran Angelovski - 中国上海的ICPBR
18. Henry Evrard - 美国的INYU,中国上海的ICPBR
19. Hualou Liang - 美国宾夕法尼亚州费城的德雷塞尔大学
20. Igor Bondar - 俄罗斯莫斯科的俄罗斯科学院
21. Jason Kerr - 德国波恩的凯撒研究中心(MPG-NKL-Group Leader)
22. Jozien Goense – 英国格拉斯哥大学
23. Juan Li - 中国科学院宁波材料技术与工程研究所
24. Kari Hoffmann - 加拿大多伦多约克大学
25. Kevin Whittingstall - 加拿大魁北克省谢布鲁克的谢布鲁克大学
26. Kristina Nielsen - 美国马里兰州巴尔的摩的约翰霍普金斯大学
27. Kristine Krug - 德国马格德堡的感觉生理学教授
28. Kostas Moutoussis - 希腊雅典大学
29. Masataka Watanabe - 日本东京大学
30. Melanie Wilke - 德国哥廷根大学
31. Michael Lippert - Neuroptics主管
32. Michael Silver - 美国加州伯克利的加州大学,视光学院
33. Michael Schmid – 英国纽卡斯尔大学
34. Natasha Sigala - 英国布赖顿萨塞克斯医学院
35. Nelson Totah - 芬兰赫尔辛基生命科学研究所助理教授
36. Oxana Eshchenko – 德国MPG生物网络学研究所
37. Paulo Ribeiro - 巴西马拉尼昂大学
38. Peter Tse - 美国新罕布什尔州汉诺威达特茅斯学院
39. Santiago Canals - 西班牙阿利坎特大学
40. Stelios Smirnakis - 美国德克萨斯州休斯顿的贝勒医学院
41. Theofanis Panayiotopoulos – 英国莱斯特大学
42. Vishal Kapoor - 中国上海ICPBR
43. Wendy Huddleston - 美国威斯康星大学密尔沃基分校
44. Xiaozhe Zhang - 中国科学院大连化学物理研究所
45. Zoe Kourtzi – 英国剑桥大学
综合研究概述
尼克劳斯·罗戈塞提斯(Nikos K. Logothetis)和村山裕介(Yusuke Murayama)与机械、电气工程师以及医疗技术助理紧密合作二十多年,分享研究项目选题和设计、数据收集和分析、演示和出版物。该团队的研究目标主要是了解非人类灵长类动物和人类认知能力背后的神经系统和子系统的连通性和自组织原理。
研究主要在非人类灵长类动物(NHP)中进行,偶尔也在啮齿类动物中进行,后者主要用于方法的优化。单个神经元和小神经元群微电路的生物物理特性可以在任何动物中进行研究,此类研究显著增进我们对微过程的了解。但是,要了解灵长类动物的大脑系统并最终深入了解人类行为及其障碍,对非人类灵长类动物(NHP)进行研究不可替代,因其具有与人类几乎相同的基本宏观连接模式和皮层组织。
重要的是,对于系统研究,我们迫切需要密集的、多学科和多尺度的方法,以调查和理解大脑结构如何相互沟通,我们需要理解并生成性地定义所谓的“网络状态”(现在完全不了解);理解可能与某些认知能力有关的序列,以及这些状态及其顺序如何保证大脑活动和认知之间的因果关系等等。只有当我们开始深入研究这些问题时,我们最终才能更好地理解系统故障。
显然,上述所有研究都需要(a)多模态方法,(b)考虑数据集的多维性和信号的不同“性质”(例如尖峰、场电位、成像信号及其传递函数)的数据分析策略,(c)将物理学中用于复杂动态系统的数学模型转移和进一步发展到高度自适应和嵌套的生物系统中,并最终(d)发展和验证能够捕捉大脑网络及其动态本质的理论。大约15年前,加拿大认知科学家、哲学家保罗·萨加德(Paul Thagard)曾说过:“没有理论的实验是盲目的,没有实验的理论是空洞的”。事实的确如此。如果想要了解大脑的功能,我们必须将实验工作与各种理论和计算方法相结合,例如累加器模型、扩散模型、更新模型、具有多个神经输入和单个、多个或合并的功能磁共振成像信号(fMRI)的多项式状态空间模型。
考虑到上述事实,在过去的二十年里,我们一直在努力开发和完善一种国际上广泛认可的方法,该方法可以实现同时颅内记录动物局部神经活动和整个大脑功能磁共振成像(fMRI)。该方法的应用为更好地理解功能磁共振成像本身做出了重大贡献。非侵入性成像方法,例如功能磁共振成像(fMRI),只能测量神经功能的替代指标,例如组织中的局部代谢变化。因此,我们必须理解潜在神经过程对代谢变化的影响,以便能够正确解释用于评估各种神经或精神疾病患者状况的功能扫描。除了方法论的发展,他们实验室在有意识视觉感知、物体识别、记忆和记忆巩固的神经机制研究方面做出了新颖且重要的贡献。
如上所述,跨学科研究将主导我们在上海国际灵长类脑研究中心(ICPBR)的工作,我们希望在认知神经科学领域继续进行研究,并进一步发展方法论,结合多尺度神经生理学、神经化学和功能性磁共振成像(MRI),以增进了我们对网络活动的理解,并提高通过成像测量的多结构活动来预测局部介观神经成像方法的可能性。以下介绍了上海国际灵长类脑研究中心(ICPBR)未来几年将继续开展的一些研究课题。
生成感知和识别的神经机制
多稳态视觉感知的初步研究
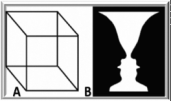 人类大脑虽以其强大的计算能力而闻名,但当它接收到视觉世界相互冲突的视图时,就会陷入深深困惑。例如,考虑左图呈现的所谓模糊图形(尼克尔立方体和花瓶与人脸)。视觉系统的光学感觉输入保持不变,但由此产生的感知解释随着时间的推移在不同的视图之间摇摆不定——这一行为称为“感知双稳态”。这些波动的发生可能是因为大脑正在接收有关视觉空间中特定位置处的物体性质的模糊信息。面对这种模糊性,大脑随着时间的推移在不同的神经状态之间波动(Blake和Logothetis,2002;Leopold和Logothetis,1999;Logothetis,1998)。
人类大脑虽以其强大的计算能力而闻名,但当它接收到视觉世界相互冲突的视图时,就会陷入深深困惑。例如,考虑左图呈现的所谓模糊图形(尼克尔立方体和花瓶与人脸)。视觉系统的光学感觉输入保持不变,但由此产生的感知解释随着时间的推移在不同的视图之间摇摆不定——这一行为称为“感知双稳态”。这些波动的发生可能是因为大脑正在接收有关视觉空间中特定位置处的物体性质的模糊信息。面对这种模糊性,大脑随着时间的推移在不同的神经状态之间波动(Blake和Logothetis,2002;Leopold和Logothetis,1999;Logothetis,1998)。
罗戈塞提斯(Logothetis)最初的研究目标是研究和理解在这种感知多稳定性下潜藏着何种神经元活动变化。他自始至终对此非常感兴趣,并且认为这不仅仅是我们视觉系统的一种怪异现象。相反,他声称这一现象揭示关于所谓的生成性感知的信息,即整个大脑的双向分层结构及其基于经验使我们意识到感官信息的方式。为了使非人灵长类动物的知觉任务变得简单,他决定研究两种通过两只眼镜分别呈现的视觉刺激之间的感知交替,这一现象称为双眼竞争(BR)(Logothetis,1998)。
在1988年罗戈塞提斯(Logothetis)开始这项研究之前,关于双眼竞争(BR)的流行理论是,它严格来说是一种优化统一立体视觉的“双眼现象”,与其他多稳态知觉现象完全无关。相应地,知觉抑制的部位被认为位于初级视觉皮层,具体表现为方向选择性细胞之间的强烈相互抑制,参见代表性综述(Blake,1989)。包括赫姆霍兹在内的一些研究人员认为双眼竞争(BR)可能与注意力有关,但随后许多其他研究人员运用不同的心理物理范式来进一步支持这一现象的准外周起源(即涉及初级而非高级联合皮层或皮层-丘脑-皮层回路)。事实上,当时的观点是,关于刺激的信息在纹状皮层(V1)输入层之后被完全屏蔽,因此无法被其他纹状体区域(例如V2、V4或MT)获取。由于纹状体子层4Ca和4B中的神经元具有定向和方向选择性,并且4B和4A子层中超过一半的细胞是双眼的,因此第4层中未减弱的活动应该足以产生定向和方向适应的后效应,如以及一系列心理物理研究中报告的眼间转移。
意料之中,罗戈塞提斯(Logothetis)在《科学》杂志上发表的论文(Logothetis和Schall,1989)是(a)首个将猴子的感知(而非感觉)与神经生理学相关联的研究,以及(b)首次提供证据表明,联合视觉皮层中的神经元活动反映了动物在经历双眼竞争时知觉交替现象的研究;重要的是,有充分的证据表明猴子确实就像人类一样执行了其任务。罗戈塞提斯(Logothetis)研究了猴子的许多视觉区域,并发现单个神经元在知觉中的参与程度随着从初级视觉皮层(V1)(10%)到早期纹状体区域(40%)和颞视觉皮层(90%)的移动而增加。就此而言,当所呈现的刺激在视觉上受到抑制时,颞叶皮层中的神经元完全保持沉默。
一个引发大量讨论的有趣问题是动物的生理发现与人类的磁共振神经成像结果之间存在明显差异,尽管这两个物种都可靠地报告了竞争期间的知觉交替。如上所述,虽然大多数V1神经元在双眼竞争期间不受知觉开关的调节,但发现人类初级视觉皮层(V1)的BOLD fMRI活动在知觉交替期间发生的变化与在视觉刺激的物理交替期间一样强烈(Cerf-Ducastel等人,2001)。然而,这种表面上的差异往往反映了注意力和意识之间的区分不清(Watanabe等,2011)。使用具有双眼抑制的二因素功能磁共振成像设计,证明视觉目标的可见性或不可见性仅在人类初级视觉皮层(V1)导致了非显著的BOLD效应。将注意力转向或远离目标对所有研究参与者都有更大、更强烈的影响。注意力和意识之间BOLD激活的下限差异说明了这两个过程分离的神经相关性。这些结果与之前报道的V1注意力BOLD效应一致,同时引发人们重新考虑V1在视觉意识中的功能作用。
然而,关于意识知觉的神经相关性的另一个主要争论涉及其皮层结构功能组织,即它是否包括介导执行功能的前额叶皮层(PFC),或者它是否被限制在后皮层内。有人提出,在研究意识知觉的范式中,PFC的活动与报告意识内容的后知觉过程或源自外源性刺激操作并通过后皮层区域传递的前馈信号混淆在一起。
人口信号、状态和知觉转换
长期以来,感知研究一直通过使用多电极阵列记录前额叶和顶叶皮层的数据进行,这种方法允许检查每个区域产生的神经活动时空模式(Panagiotaropoulos等,2014;Panagiotaropoulos等,2013);Safavi等人,2014)。在其中一项研究中,使用统一的神经元竞争模型来研究双眼闪现抑制(BFS)(一种外部诱导的知觉抑制形式)中适应和噪声过程的动态,并将其与双眼竞争(BR)中内在驱动的交替动态进行比较。竞争(BR)。该研究表明,在BFS期间,在外侧前额叶皮层(LPFC)的电生理记录中检测到的知觉调制神经元群体的平均群体放电模式限制了外部诱导的知觉转换的动态范围限制在分叉点周围,该分叉点将噪声驱动的吸引子状态和适应驱动的振荡状态分开(Panagiotaropoulos等,2013)。
上述研究中使用的LFP多电极记录也为研究毫米尺度的神经活动的时空组织提供了机会。特别是,振荡LFP相位允许研究神经振荡在时间和空间上的协调,并将其与认知处理联系起来。鉴于LFP相位在计算中的作用,了解它们与生成它们的底层电流源密度(CSD)相位之间的关系非常重要。通过使用体积导体模型来表征LFP和CSD相位模式之间的差异,从事感知研究的小组揭示了这些信号之间差异的来源,这对于理解局部-全局相互作用至关重要(Hindriks等,2016)。
视觉皮层区域之间的相互作用
关于意识知觉的神经相关性的一个主要争论涉及其皮层组织,即它是否包括介导执行功能的前额皮层(PFC),或者它是否被限制在后皮层内。有人提出,在研究意识知觉的范式中,PFC的活动与报告意识内容的后知觉过程或源自外源性刺激操作并通过后皮层区域传递的前馈信号混淆在一起。
这一争论最近通过采用一种有趣的双眼运动竞争的“非报告”范式得以解决。在这个范式中,可以简单地从眼球运动(例如视动眼球震颤)中推断出瞬时感知内容以及内容的自发转换,而不是通过主动按下杠杆来对应感知的一种或另一种刺激(Kapoor等人,2022)。
结果表明,在外部诱导和内部产生的意识知觉变化中,特征选择性前额叶神经元的调节与主观知觉和对其偏好刺激的知觉抑制同时发生。重要的是,这使得能够对意识内容进行可靠的单次试验、群体解码。对照实验证实,即使用于推断感知的动眼神经反应被抑制,刺激内容也会得到了显著解码。这些发现表明,在意志报告或感觉输入变化缺席的情况下,意识视觉感知内容内部生成的变化可靠地反映在前额叶群体的活动中(Kapoor等人,2022)。
视觉对象识别的神经基础
视觉认知并非一张白纸。即使是新生儿,他们来到这个世界时也带着指向他们学习周围面孔和地方的偏见。视觉认知中最具建设性的过程之一就是对象识别,因为我们对周围物体的三维理解仅通过视网膜上某处短暂的、经常被遮挡的二维光点来了解。其余的过程取决于我们的大脑,并基于广泛的视觉经验为基础。换而言之,认知能力,如感知、识别和学习,具有生成性质。
任何生物识别系统必须解决的任务的多样性表明,对象识别不是一个单一的通用过程。就此而言,来自心理学、神经心理学和神经生理学领域的证据支持存在多种识别系统的观点。来自正常成人、婴儿、动物和脑损伤患者的数据揭示了基本类别级别的对象分类和从同质对象类中识别单个对象之间的主要区别。此外,心理物理学和神经生理学研究表明,一个系统可以通过多个视图或方面的组合来表示对象,而另一个系统可以通过结构基元及其空间相互关系来表示对象。(Hoffman和Logothetis, 2009; Logothetis, 2000; Logothetis和 Sheinberg,1996b)。
灵长类动物的显著特征是对面孔和面部表情的识别。人类的面部特定处理首次在临床研究中得到证实。面容失认症是一种面部特定失认症,使患者无法识别熟悉或著名人物的面孔,但保留他们识别常见物体的能力(Logothetis,2000)。猴子的面部识别系统与人类的面部识别系统极为相似。因此,该物种的大量神经组织也致力于处理面部信息,这并不令人惊讶。
非人类灵长类(NHP)的识别相关皮层通路起源于初级视觉皮层,并延伸至V2和V4的辅助纹状体区域直至颞叶皮层。在此通路中,层级最高的专门视觉关联区域是下颞叶皮层(IT)。正是在这个区域,查尔斯·格罗斯(Charles Gross)在20世纪70年代初发现了所谓的面部细胞(Gross等人,1969; Gross等人,1972)。在他们的开创性研究中,作者报告了一些对复杂形状(例如手、树、人和猴子面孔)反应最好的细胞,为Konorski的认知单元的神经生理学相关性提供了第一个证据(Konorski,1967)。但面部是唯一以这种方式表示的对象吗?我们在经过强化和优化训练的NHP中结合一系列心理物理学和电生理学实验解决了这个问题(Logothetis和Pauls,1995;Logothetis等人,1994;Logothetis等人,1995)。
这些研究首次提出证据表明,灵长类动物的大脑在识别任意同质类别的人造物体时,至少可以采用面部处理的一个方面,即整体信息的处理,而猴子必须单独学习、记住并从大量与目标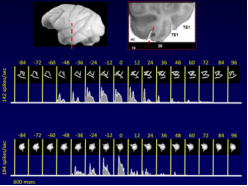 具有许多共同特征的干扰物中一次又一次地识别这些物体(参见左侧为计算机构建的人造物体,如电线和阿米巴视图特定神经活动)。获得这种专业知识可以诱导视觉系统中神经元反应的配置选择性。这些发现表明,就其神经编码而言,面孔不太可能被认为是“特殊的”,而是灵长类视觉系统默认的“特殊类别”(Logothetis,2000)。
具有许多共同特征的干扰物中一次又一次地识别这些物体(参见左侧为计算机构建的人造物体,如电线和阿米巴视图特定神经活动)。获得这种专业知识可以诱导视觉系统中神经元反应的配置选择性。这些发现表明,就其神经编码而言,面孔不太可能被认为是“特殊的”,而是灵长类视觉系统默认的“特殊类别”(Logothetis,2000)。
具体而言,大多数神经元在视平面旋转过程中也表现出对3D方向依赖性反应。一些神经元被发现围绕同一物体的两个视图进行调整,而极少数细胞以视图不变的方式做出反应。对于在动物训练过程中广泛使用的五种不同物体,并且其行为表现变得与视图无关,发现多个细胞围绕同一物体的不同视图进行调整。对于动物系统性无法识别的视图,从未观察到有任何选择性反应。这些结果表明,由于物体辨别和识别方面的广泛训练,该颞区的神经元可以形成复杂的感受野组织。简单的几何特征似乎无法解释神经元的选择性反应。(Logothetis和Pauls,1995;Logothetis等人,1994;Logothetis等人,1995;Logothetis和Sheinberg,1996a)。
在获得初步结果后,Logothetis在猴子执行一个涉及两组参数刺激的分类任务时记录了单个神经元的活动。每个刺激集包含四个不同的特征,但四个特征中只有两个对于分类任务(诊断特征)很重要。选择性地增强了神经元对诊断特征的代表性,这表明对分类重要的刺激特征体现在灵长类动物下颞叶皮层的单个单元(神经元)的活动中(Sigala和Logothetis,2002)。
最后但同样重要的是,研究项目集中于多感官感知和识别的神经基础。具体而言,人类的语音感知通常通过听觉和视觉信号的结合加以增强。毫不奇怪,动物,尤其是非人类灵长类动物,也以独特的身体姿势和面部表情伴随着它们的叫声,尽管尚不清楚这些信号的解释是否统一。Ghazanfar和Logothetis使用了一种范式,其中监控“优先注视”来检查非人类灵长类动物是否也能够识别其呼叫的听觉和视觉部分之间的对应关系。结果表明,猕猴具有将声音呈现的同种发声与适当的面部姿势相匹配的固有能力。结果的模式与前语言期人类婴儿使用相同的优先注视范式进行跨模式语音识别的模式非常相似。然而,这是动物声音交流系统中听觉-视觉整合的首次证明(Ghazanfar和Logothetis,2003)。
神经血管系统识别以优化fMRI信号的解释和应用
上述多学科和多尺度方法也可以极大地帮助我们开发功能磁共振成像信号的现实数学模型,允许它们与神经信号一起用于描述大脑系统和子系统的动态。
然而,研究神经血管系统的道路绝非一帆风顺。在处理复杂的整体(例如由神经、神经胶质和血管成分组成的整体)时,成熟的经典系统识别技术就显得不足。更重要的是,当某些大脑结构的神经血管整体似乎具有强大的反馈回路(即血管活动调节神经活动)时,就属于“非因果”系统的范畴。
通过成功地将神经生理学和功能磁共振成像实验相结合,人们不仅可以通过直接记录单个神经元、微电路和柱状体的活动深入探究代谢需求上调和下调的神经起源,还可以估计具有多个神经输入和选择性功能磁共振成像子信号多项式状态空间的模型。接下来的内容提供了相关系统组件的概要描述,对这些组件的理解可能有助于使用多结构活动来定位和预测神经活动。
皮层微电路对fMRI信号的影响
显然,正确解释MRI信号需要考虑微电路的组织原则,皮层微电路就是一个经过充分研究的案例。具体而言,兴奋-抑制(E-I)微电路具有某些独特的特征:(1)与点神经元相比,每个真实神经元的最终响应由所有前馈、反馈和调制突触决定,而非由其输入的线性总和决定;(2)短暂的兴奋反应是由主导兴奋引起的,例如由于小的突触延迟或信号传播速度的差异,因此迅速进行抑制,然后是平衡活动;(3)当传入神经向相反方向驱动总体E-I平衡时,可能会出现净兴奋或净抑制;(4)在保持良好平衡的兴奋-抑制的同时,可能会发生对大型、持续的输入变化的响应;(5)E-I微电路的强烈递归使它们能够对短暂刺激产生持续的响(微电路记忆)(详细描述和引用参见(Logothetis, 2008))。
由此可见,具有平衡E-I的变化是调整皮层输出的整体兴奋性和信噪比机制的良好候选,并且根据其工作模式,微电路可以作为驱动器,忠实地传输与刺激或运动相关的信息,或作为调节响应的整体敏感性和上下文特异性的调节器。
对于系统级别的研究,了解是否可以识别和测量不同类型的活动,以及是否可以通过神经调节和反馈来实现这种处理的精细调节非常重要。哪些方面可以最好地从电生理学角度进行研究,哪些方面需要诸如各种类型光学成像的局部测量?
在我们许多微电路级别的项目中,我们的工作假设是细胞外场电位的各个方面可能在某种程度上揭示了E-I微电路的不同操作模式,如果将来自不同区域同时记录的信息组合在一个实验会话中,这反过来可能会告诉我们一些有关联想网络状态的信息。大量观察结果表明,E-I皮层微电路的状态确实会影响网络的整体行为。例如,网络频率取决于突触时间尺度以及兴奋和抑制之间的平衡(参考文献见(Mazzoni等人,2008))。同样,E-I回路的多模态操作很可能是大脑复杂活动模式的原因之一,其具有异常丰富的空间和时间结构,这种结构或“内部状态”仍然对外部感官输入非常敏感。
为了探讨这一系列问题,在包括视觉、听觉、体感和高级联想皮层在内的不同皮层区域进行实验,并在建模工作的同时开发了分析方法(Belitski等人,2010;Besserve等人,2010;Eschenko等,2011;Ludtke等,2009;Mazzoni等,2010;拉什等人,2009)。接下来的步骤涉及检查这些结果在其他感觉系统中的有效性,最重要的是检验其在行为背景下的有效性。个体、非冗余频率范围的调制、不同类型活动的可预测性(例如来自不同LFP频段的尖峰)以及不同行为环境中各种信号的分离可能最终开始揭示机制,而不仅是报告微观活动和行为之间的相关性。
研究微电路活动时的一个重要问题是考虑到这些结构密集的微连接性,它们可能编码的信息量。人们通常认为这种微电路中的功能性、动态连接性是决定神经元活动中试验之间相关变异的一个因素。过去的大量研究报告了相邻皮层细胞之间存在高度相关的变异性。最近,为了重新审视这个问题,在清醒的猕猴初级视觉皮层中开发了长期植入的多电极阵列,它提供了前所未有的记录质量。研究结果表明,即使是取向调谐相似的相邻神经元也几乎不存在相关变异(Ecker等人,2010)。这些发现表明以下两中可能性之一:相邻神经元仅共享其输入的一小部分,或者它们的活动被主动去相关。有趣的是,某些感知状态也具有主动去相关特征(见下文),并且这可能是从一个微电路到另一个微电路最大化传输信息基本条件之一。
代谢活动上调和下调的解释
神经事件触发(NET)fMRI结果提出了正确解释fMRI信号的问题,该信号与新陈代谢的变化而非神经活动相关。自发活动期间MR信号的解释更为复杂。原则上,振荡和同步性可以通过提高突触效率来降低代谢需求。然而,振荡和伽马节律与高能量需求相关,需要高氧化能量代谢、强大的线粒体表现以及充足的氧气和营养供应(Kann,2011;Lord等,2013)。
一般而言,皮层中阳性BOLD反应(PBR)的差异可以通过麻醉或未用药动物中LFP衍生的不同带限功率信号的动态进行最佳解释。对LFP本身的解释可能也需要谨慎,因为它反映了感觉输入和神经调节引起的局部兴奋抑制平衡的变化(Goense和Logothetis,2008;Lippert等,2010;Logothetis等,2001)。然而,神经元抑制和BOLD反应的关系并非一目了然。抑制可能会增加或减少能量消耗,具体取决于局部中间神经元参与的程度(Logothetis,2008)。某些中间神经元类别直接控制血流调节(Buzsaki等,2007),并且负性BOLD反应(NBR)的血流动态机制与PBR不同(Goense等,2012)。尽管如此,NBR本身可能被视为集群活动减少的合理标记,因为它通常与多单位活动(MUA)的减少相关(Logothetis,2008;Shmuel等,2006)。
利用电生理记录和功能磁共振成像研究神经血管耦合
关于神经血管耦合的首个研究结果于2001年在《自然》杂志上发表。该研究首次展示了皮层内神经信号和功能磁共振成像反应的同步记录。研究结果表明,fMRI BOLD对比机制反映了给定区域的输入和皮层内处理,而不是其尖峰输出。事实上,BOLD反应的增加可能与投射神经元放电的强烈减少同时发生。后续的一些研究也表明,功能磁共振成像信号无法轻易区分功能特定的处理和神经调节、无法区分自下而上和自上而下的信号,并且可能会混淆兴奋和抑制。功能磁共振成像信号的强度无法精确量化以准确反映大脑区域之间或同一区域内任务之间的差异。后一个问题产生的根源并不是我们目前无法根据BOLD信号准确估计氧合度,而是血流动态响应对被激活的群体大小敏感,这可能会随着神经表征的稀疏性在空间和时间上的变化而变化。在与刺激或任务相关的感知或认知能力稀疏表现的皮层区域(例如,在极少数神经元活动中实现),容积传递可能构成动机、注意力、学习和记忆状态改变的基础,可能会主导血流动态反应,并且无法推断出该区域在当前任务中的确切作用。
开发理解大脑网络的多学科方法
大脑:极其复杂动态系统
大脑具有大量的元素、超高的结构复杂性和巨大的连通性,所有这些都会在经验的影响下发生改变和进化。与传感器和效应器相关的信息以并行和递归的分层方式进行处理。不同层级之间的连接是双向的,其特异性和有效性由关联中心和神经调节中心进行持续控制。通常,任何观察到的大脑活动都具有概率性,其发展取决于初始条件。
在数学物理学中,此类系统被称为复杂动态系统(CDS),其中“复杂”并不意味着难以理解。相反,它意味着整体的行为是在自组织过程中出现的,并且不能还原为系统的组成部分,也不能通过系统的组成部分进行预测。
复杂系统在自然界中无处不在,从非适应性复杂动态系统(naCDS),例如对流细胞、雪花、天气和气候模式,到适应性复杂动态系统(aCDS),例如经济、社会系统、基因组以及神经系统。
上述大多数例子长期以来都使用这种复杂动态系统方法进行了深入研究,这些研究无疑提高了我们预测“随机”系统状态演化路径的能力。一个突出的例子是当前令人印象深刻的天气和气候变化轨迹,这两种都是具有混沌动态的耗散动力系统,拥有全局吸引子,其预测具有有限的时效性不足为奇(Soldatenko&Yusupov,2021)。
相比之下,复杂动态系统(CDS)在系统神经科学中的应用非常有限,而且相当具有“选择性”,主要在几乎完全使用神经成像技术的人类研究中,例如各种形式的功能磁共振成像(fMRI)(Bullmore和Sporns,2009;Friston,2002;Ryali等人,2016)。然而,在这种情况下,神经活动只能间接估计,主要反映代谢能量需求的变化。这类测量无法区分输入/输出特定的处理和神经调节、无法区分自下而上和自上而下的信号,并且它们可能会偶尔混淆兴奋和抑制(Logothetis,2008)。此外,功能磁共振成像提供的信息大多处于宏观尺度水平——除非结合极高场扫描仪和脑电图(EEG),这可能会提供一些细观尺度信息,例如(Bandettini等人,2021)——目前无法用于估计潜在的局部神经活动和微观自组织过程。
现在,系统神经科学中的多模式方法比以往任何时候都更加必要,尤其是对于大脑功能和功能障碍的研究。这种方法肯定会包括对MRI技术的进一步改进,但最重要的是,应该能够将其与其他直接评估大脑电活动和神经化学活动的侵入性技术相结合。
对大脑结构特定的血流动力学响应函数(HRF)的神经基础的深刻理解,以及允许从fMRI时间序列估计神经信号的反卷积模型,同样非常重要。在成功结合神经生理学、神经化学和功能磁共振成像的实验中,人们不仅可以通过直接记录单个神经元、微电路和组件(例如皮层柱)的活动来探究代谢模式上调和下调的神经起源,还可以使用收集到的多模态和多尺度数据来实地实现复杂动态系统(CDS)的应用,后者是准确描述大脑状态、状态转换和序列以及后者与我们认知能力之间关系的唯一方法。
与学习和记忆相关的神经子系统
众所周知,大脑的核心功能是创建并保留可以指导行为的内在世界表征。简单来说,记忆就是这种“保留”。然而世界在不断变化,严格、僵化的保留,那么这种保留可能是无价值的,甚至可能是有害的。因此,学习,即不断调整表征以适应变化环境的过程,是一种重要的补充性大脑功能。学习和记忆都是反映大脑多级微观网、中观网和宏观网协同操作的自组织系统属性。在丰富的实验证据的基础上,有人提出学习和记忆至少由三个子系统(Delacour, 1999)在合作协同功能中实现。
第一个子系统负责以高度精确的方式编码和表示感觉信息或运动程序,它可能由初级感觉和运动区域、联合皮层以及纹状体和小脑等结构中的神经元组件组成。
第二个子系统由与感觉输入或运动输出没有精确关系的神经元组装组成,但能够反映了生物体的内部状态,例如唤醒或动机。该子系统被认为包括网状结构、中缝核、蓝斑、一些丘脑/下丘脑核、端脑的基底核(Meynert),以及由间脑和大脑组成的边缘系统,如丘脑前核和间隔核、下丘脑、乳头体、扣带回、海马旁回和海马体。
最后,第三个子系统服务于行为的目标导向特征,可能包括前额叶皮层等结构。最后一个子系统很可能是在前两个子系统的协调和协同作用下实现的。
这些子系统内部和之间的协同或拮抗作用被认为反映了各种类型的短期或长期振荡活动的同步性(Buzsaki等人,2013;Freeman,2008),这些活动在包括丘脑皮层系统、基底神经节、海马结构和脑干在内的各种系统中得到了详细研究。节律性活动通常反映神经元群体的相互作用(Buzsaki,2002;Sirota和Buzsáki,2005),尽管在丘脑皮层网络的情况下,它也可能是由单个神经元在特定内在电流之间的相互作用下产生(Steriade和Llinas,1988)。
波和内在神经事件:大脑状态的全局概率指标
以慢速振荡活动为例,通常被称为慢波,涉及丘脑和皮层结构(McCormick和Bal, 1997;Steriade等人,1993)。在这种慢速(0.5-1.5 Hz)振荡中,兴奋性和抑制性细胞的膜电位在去极化(上升)和超极化(下降)状态之间交替,这些兴奋性阶段及其转变强烈影响其他皮层(Amzica和Steriade,1997;Molle等,2002)和海马(Battaglia等,2004;Molle等,2006;Sirota等,2003)振荡模式的发生频率。
另一个例子是在海马局部场电位(LFP)大幅度偏差期间观察到的快速振荡活动,称为尖波。快速场振荡(从100到超过300Hz,具体取决于物种)被称为尖波波纹(SWR)(Buzsaki等人,1992年;O'Keefe和Nadel,1978年)。尖波波纹(SWR)是所谓自发内在神经事件(INE)的一个典型例子。
有趣的是,ripple快波是一种释放现象。在活跃的清醒状态下,海马体(HP)受theta节律支配。这种节律由从脑干延伸到内侧隔膜和布罗卡对角带(MSDB)、海马体和内嗅皮层的细胞网络控制(Buzsaki,2002)。MSDB调节海马体中间神经元和主细胞的子集,产生局部theta节律(Buzsaki,2002)。当theta节律减小时,CA3网络表现出高度同步的尖峰脉冲群,在辐射层CA1锥体细胞的树突中产生较大的LFP偏转。CA1的大规模去极化反过来会引起上述细胞群之间的短暂的动力学相互作用,产生波纹(Buzsaki等人,1992)。SWR在时间上与皮层纺锤体(Axmacher等,2006;Siapas和Wilson,1998)以及慢速振荡相关,并且被认为是大规模振荡网络系统的一部分。这些网络的耦合被认为可以协调新皮层和海马体细胞组件之间的特定信息传递(Isomura等人,2006;Sirota和Buzsáki,2005;Wierzynski等人,2009)。
另外一类与全脑活动相关的广泛研究的非侵入性神经电生理指标是桥脑、外侧膝状体(LGN)和枕叶皮层记录的相位电位。这些电位构成了快速眼动(REM)睡眠的标志性特征(Datta,2010)。与尖波类似,桥脑-膝状体-枕叶波(PGO波)很短(约100毫秒),但LFP偏转相对较大(> 300 µV)。PGO波的首次详细描述和传播来自猫的脑桥、LGN和皮层的电生理记录(Bizzi和Brooks,1963;Brooks和Bizzi,1963)。PGO波与包括感觉运动整合、做梦、发育和学习在内的多种重要的大脑功能相关(Datta,2000)。它们与大规模网络的关系最近也在人类功能磁共振成像研究中得到了证明,这些研究报道了在没有任何视觉输入的情况下,脑桥被盖、腹后丘脑和初级视觉皮层的快速眼动相关激活(Miyauchi等人,2009)。
数十年的动物和人类实验工作表明,上述INE示例反映了自组织大规模网络的状态变化。在学习之后,波纹的数量会增加,并且其强化似乎可以预测大鼠(Eschenko等人,2008;O'Neill等人,2008)和人类(Axmacher等人,2008)的记忆回忆。相反,在学习后慢波睡眠(SWS)(也称为NREM,即非快速眼动睡眠)期间通过HP电刺激消除波纹会干扰记忆巩固(Ego-Stengel和Wilson,2010;Girardeau等人,2009)。同样,PGO波和REM睡眠的中断似乎会选择性地干扰程序性知识的保留(Bavelier等,1998)。
显然,此类网络的确切拓扑结构以及随着时间的推移而演变所产生的新兴动态活动模式可能是特定大脑功能和功能障碍的优秀指标。然而,神经事件的电生理记录通常涉及通过其解剖连接模式或通过先前在行为背景下建立的结构的协作相互作用来选择的一个或多个大脑区域。由于缺乏允许同时进行局部记录和全脑活动映射的方法,与事件相关的全局状态仍然难以捉摸。另一方面,功能性MRI提供了自发或刺激涉及的多结构活动(MSA)的完整模式,但没有同时记录局部波或自发内在事件。目前不可能基于MSA模式精确预测任何事件。
同时记录INE和MSA:首次对睡眠中记忆巩固的系统洞察
目前关于睡眠中记忆巩固的机制有两种主要假说。一种是突触稳态假说,认为记忆巩固是睡眠期间全局性突触缩小过程的副产品;另一种是活跃系统巩固假说,认为睡眠期间选择性重新激活记忆可导致活跃的巩固过程。然而,这两种模型并非相互排斥;所假设的过程可能共同作用,以优化睡眠的记忆功能。大量数据支持睡眠促进经验依赖性突触雕刻(Blanco等人,2015; Calais等人,2015; Ribeiro, 2012)的观点,这实际上被理解为在记忆编码时同时激活的不同但互补的突触集合的非赫布式缩小和赫布式增大,因此睡眠对它们有不同程度的影响,例如参见综述(Diekelmann和Born,2010;Dudai等人,2015)。
不到十年前,同步电生理记录和fMRI表明,SWR事件实际上与皮质强烈活动同时发生,并与大范围边缘脑结构强烈抑制同时发生,这些结构与神经可塑性密切相关,如基底神经节(BG)、小脑皮质和脑桥区(PONS)(即上行网状激活系统),可能参与突触巩固(Logothetis,2015;Logothetis等,2012)。值得注意的是,在灵长类动物中,PONS区的负BOLD与外侧膝状体(LGN)和中央窝V1活动的抑制系统性地相关,尽管周边V1和其他所有初级感觉和联合皮层表现出整体的积极fMRI反应。因此,PONS的去激活可能是由于暂时抑制了参与局部可塑性和突触巩固的乙酰胆碱能位点,如theta节律PGO波的产生和传播。
如果PGO波确实与上述程序记忆或突触巩固有关,那么PGO波与SWR的时间关系以及MSA模式的动态可能有助于我们理解系统巩固和突触巩固过程之间的相互作用。最近的一项研究,再次将NET-fMRI与海马体、丘脑和副翼核(PBn)区域的多分支和多站点记录相结合,确实表明脑干通过相位PGO波短暂调节海马网络事件(Ramirez-Villegas等)等,2021)。
值得注意的是,发现了两种生理上明显不同的PGO波(睡眠中的快速眼动),分别选择性地影响高频ripple快波和低频theta慢波事件。这两种PGO波与海马体的尖峰场耦合相反,在海马体中,ripple和theta事件期间神经元群体的神经同步性增强。
PGO波和海马ripple快波的耦合既新颖又令人惊讶。此外,PGO波可能与海马Theta样爆发在短时间内同时发生,就像啮齿动物和猫在快速眼动睡眠期间发生的情况一样。这种选择性神经元整体调节的假定机制有两点:首先,胆碱能神经调节与上升脑干-海马同步通路相关,该通路终止于布罗卡的内侧隔膜和对角带,已知该通路在海马Theta节律的产生中发挥关键作用,其次,正如解剖学研究表明的那样,脑桥直接输入到海马体本身。
PGO波对海马尖峰场耦合影响的观察提出了一种假定机制,该机制可以解释NREM和REM样状态期间兴奋性的剧烈相反变化(Grosmark等,2012)。这种互补机制可能是由跨越睡眠状态的常见现象(即PGO波)控制。这些代表脑干细胞同步去极化的事件,可能与NREM和REM类似状态期间促进海马体可塑性窗口相对应,并且这可能通过低频调制的SWR和Theta事件序列来实现。这一假设与体外研究(Huerta和Lisman,1995)和体内研究(Poe等人,2000)一致,强调了研究全脑瞬态机制以在系统水平上了解大脑功能的重要性。
最后,PGO波和ripple快波之间的耦合(通常与明显不同的睡眠阶段相关)支持一种观点,即胆碱能脑桥瞬变引起的海马体睡眠动力学的全局协调机制可能促进系统和突触记忆巩固以及突触稳态。
精选文章
双稳态知觉的神经机制
 我们在图宾根和上海的研究目标是研究和理解知觉多稳定性背后的神经元活动变化,例如左侧所示的内克尔立方体所经历的变化。我们过去并继续对此感兴趣,因为我们相信这不仅仅是视觉系统的一个怪癖。相反,我们相信它告诉我们一些有关整个大脑的组织及其使我们意识到所有感官信息的方式的信息。为了使非人类灵长类动物的知觉任务变得简单,我们决定研究当两种不同的视觉模式同时呈现给每只眼睛时所经历的交替现象,这种现象称为双眼竞争(BR)。在我们开始这项研究之前,关于双眼竞争的主流理论是,它严格来说是一种“双眼现象”,旨在优化统一立体视觉,与其他多稳态知觉现象完全无关。
我们在图宾根和上海的研究目标是研究和理解知觉多稳定性背后的神经元活动变化,例如左侧所示的内克尔立方体所经历的变化。我们过去并继续对此感兴趣,因为我们相信这不仅仅是视觉系统的一个怪癖。相反,我们相信它告诉我们一些有关整个大脑的组织及其使我们意识到所有感官信息的方式的信息。为了使非人类灵长类动物的知觉任务变得简单,我们决定研究当两种不同的视觉模式同时呈现给每只眼睛时所经历的交替现象,这种现象称为双眼竞争(BR)。在我们开始这项研究之前,关于双眼竞争的主流理论是,它严格来说是一种“双眼现象”,旨在优化统一立体视觉,与其他多稳态知觉现象完全无关。
相应地,知觉抑制的部位被认为位于初级视觉皮层,具体表现为方向选择性细胞之间的强烈相互抑制,参见代表性综述(Blake,1989)。包括亥姆霍兹在内的一些研究人员认为双眼竞争可能与注意力有关,但随后许多其他研究人员使用各种心理物理学范式来进一步支持双眼竞争的准外周(即初级而不是高级联合皮层,或皮层-丘脑-皮层回路)起源。事实上,当时的观点是,关于刺激的信息在纹状皮层(V1)输入层之后被完全屏蔽,因此无法被其他纹状体区域(例如V2、V4 或MT)获取。由于纹状体子层4Ca和4B中的神经元具有定向和方向选择性,并且4B和4A子层中超过一半的细胞是双眼的,因此第4层中未减弱的活动应该足以产生定向和方向适应的后效应,如以及一系列心理物理研究中报告的眼间转移。
据我们所知,我们1989年在《科学》杂志上发表的文章是(a)首个将猴子的感知(而非感觉)与神经生理学相关联的研究,以及(b)首次提供证据表明,联合视觉皮层中的神经元活动反映了动物在经历双眼竞争时知觉交替现象的研究;重要的是,有充分的证据表明猴子确实就像人类一样执行了其任务。
主观视觉感知的神经元相关性
LogothetisNK,Schall JD(1989)Science 245:761-763。
中颞区(MT或V5)的实验揭示了不同的类型的细胞群体,其活动在与双眼运动竞争过程中,以不同程度、复杂的方式受到调节(Logothetis和Schall 1989年)。许多细胞仅在神经元偏好方向被感知时才活动,其他细胞仅在刺激被抑制时活动(Levelt的第二个命题)。还发现其他神经元仅在刺激的知觉(而不是物理)交替期间才活跃。这项研究引起了大众媒体和科学界的广泛关注,其中包括本杰明·利贝特(Benjamin Libet)首次讨论了该研究对意识知觉的影响;参见(Logothetis,1990)的回应。然而,MT神经元接收来自纹状皮层第4B层和第6层的直接输入!因此,目前尚不清楚MT中与感知相关的反应调节是否是该区域的特性,或者反映了纹状皮层中发生的活动变化。
初级视觉皮层活动的变化反映了猴子在双眼竞争期间的知觉
Leopold DA, LogothetisNK(1996)Nature 379:549-553
为了确定其他视觉皮层区域是否发生与感知相关的活动调节,我们在猴子报告两个正交方向竞争性网格的知觉方向时,记录了V1、V2和V4中单个神经元的活动。许多细胞,特别是V4细胞,表现出与一种刺激的知觉主导和抑制相关的活动模式。大多数都是方向选择性的,并且可以同样良好地从两只眼睛驱动。之前有人提出,双眼竞争涉及V1中单眼神经元之间的相互抑制,但我们的结果并不支持这一观点。相反,我们提出,双眼竞争是通过视觉通路中多个层面的双眼神经元之间的相互作用而产生,并且类似的机制可能是观看模糊图像时发生的其他多稳态感知状态的基础(Leopold和Logothetis 1996)。
这篇论文发表后,弗朗西斯·克里克(Francis Crick)在《自然》杂志的一篇评论中表示,“虽然普通读者可能没有意识到,这两篇论文(Logothetis和Schall,1989;Leopold和Logothetis,1996)是对令人困惑的意识问题进行联合进攻的开端之一。对于这项任务,灵长类动物的视觉系统似乎特别有吸引力。这两篇论文展示了一种研究意识神经相关性的直接方法。”当然,他的评论非常捧场,但实事求是地说,我们的工作确实引发了许多类似的评论和文章,多到我无法回忆起所有内容。这确实令人鼓舞,但请放心:“意识”仍然是一个谜!大约一年后,我发表了第一项明确的证据,证明竞争反映的是模式的交替,而不是眼睛的优势(Logothetis, Leopold等人1996)。
双眼竞争时竞争究竟是什么?
LogothetisNK、Leopold DA、Sheinberg DL(1996)Nature 380:621-624。
我与当时分别是博士后和学生的大卫·谢因伯格(David Sheinberg)和大卫·利奥波德(David Leopold)对快速交替在两只眼睛之间呈现竞争性刺激的效果进行了测试。在这些条件下,知觉交替表现出与静态模式相同的时间动态,并且一个知觉主导阶段可以跨越多个刺激交替。因此,两个刺激在视觉意识中的神经表示通过它们到达高级视觉区域的眼睛独立竞争。这一发现将双眼竞争归入多稳态现象(例如模糊图形)的一般范畴,并为研究感知模糊的神经原因和解决办法提供了一种新方法。与此同时,我们开始对猴子下颞叶皮层的电活动进行记录(Logothetis,Leopold等人,1996)。
颞叶皮层区在知觉组织中的作用
Sheinberg D,LogothetisNK(1997)PNAS,94:3408-3413。
 灵长类动物颞叶视觉区域一直被认为是视觉对象表示的重要区域。为了研究这些区域在刺激视觉意识中的作用,我们记录了在观看模糊刺激时经过训练精确报告其知觉的猴子单个神经元的活动。如上所述,我们对经历双眼竞争的猴子的V1、V2、V4和MT区域的首次记录表明,只有少数皮层和早期额外皮层神经元在驱动刺激可见时专门放电。相反,我们发现下颞叶皮质和顶叶颞沟皮质的视觉区域几乎所有神经元的活动都取决于有效视觉刺激的知觉主导。因此,这些区域似乎代表了一个超越模糊性解决的处理阶段,因此也超越了知觉组织过程和图像分割过程,其中神经活动反映了大脑对物体的内部视图,而不仅仅是简单视觉特征或形状原语编码细胞受视网膜刺激影响的效果。
灵长类动物颞叶视觉区域一直被认为是视觉对象表示的重要区域。为了研究这些区域在刺激视觉意识中的作用,我们记录了在观看模糊刺激时经过训练精确报告其知觉的猴子单个神经元的活动。如上所述,我们对经历双眼竞争的猴子的V1、V2、V4和MT区域的首次记录表明,只有少数皮层和早期额外皮层神经元在驱动刺激可见时专门放电。相反,我们发现下颞叶皮质和顶叶颞沟皮质的视觉区域几乎所有神经元的活动都取决于有效视觉刺激的知觉主导。因此,这些区域似乎代表了一个超越模糊性解决的处理阶段,因此也超越了知觉组织过程和图像分割过程,其中神经活动反映了大脑对物体的内部视图,而不仅仅是简单视觉特征或形状原语编码细胞受视网膜刺激影响的效果。
有趣的是,在某些条件下知觉交替可以减慢甚至停止。例如,当以双眼模式间歇性观看,无论是通过重复呈现还是通过定期闭眼,知觉可以在一段时间内锁在一种配置上(Leopold,Wilke等人,2002;Maier,Wilke等人,2003)。这种稳定化的一部分可能是模糊刺激缺失期间持续存在的知觉记忆。这种记忆实际上对于自然视觉可能很重要。我们进一步提出,此处介绍的交错范式在衡量衡量特定知觉组织机制吸引的刺激相似性方面具有很大价值。
总而言之,我相信我们对知觉模糊性的研究能够为双眼竞争和视觉感知带来一些新的见解。它们引发了大量使用EEG、MEG和fMRI等不同方法的心理学、生理学和认知科学领域的研究。顺便一提,从1921年到1988年期间,有关双眼竞争的出版物只有202篇,其中绝大多数集中在独眼视觉现象的作用上。在我们发表论文之后的时期,即1989年至2011年,出版物数量超过1200篇,我们的文章被引用约2000次。从那时起,讨论就集中在知觉交替的核心起源以及这种现象为意识知觉提供见解的能力上。
 事实上,现在人们普遍认为(即使是那些最初强烈主张眼间竞争而而非感知竞争的人,例如R. Blake、H. Wilson等)竞争并不能真正反映眼间竞争。眼间抑制性相互作用最有可能是当两个不相容的刺激叠加时产生的局部冲突的原因。这种冲突可能在有或没有双眼刺激的情况下出现,并且很可能是双眼或单眼竞争期间经历的不稳定性的根源。然而,它们很难解释刺激选择和知觉生成过程。竞争过程中模式的优势和抑制反映了高级视觉区域中细胞群的兴奋和抑制,这些区域直接参与视觉模式的表征。目前,我们正在人类和猴子身上进行大量同时进行的心理物理学、生理学和功能磁共振成像研究,以便更好地了解参与知觉主导和刺激抑制的网络拓扑结构,然后研究感知交替期间的皮层微电路行为。
事实上,现在人们普遍认为(即使是那些最初强烈主张眼间竞争而而非感知竞争的人,例如R. Blake、H. Wilson等)竞争并不能真正反映眼间竞争。眼间抑制性相互作用最有可能是当两个不相容的刺激叠加时产生的局部冲突的原因。这种冲突可能在有或没有双眼刺激的情况下出现,并且很可能是双眼或单眼竞争期间经历的不稳定性的根源。然而,它们很难解释刺激选择和知觉生成过程。竞争过程中模式的优势和抑制反映了高级视觉区域中细胞群的兴奋和抑制,这些区域直接参与视觉模式的表征。目前,我们正在人类和猴子身上进行大量同时进行的心理物理学、生理学和功能磁共振成像研究,以便更好地了解参与知觉主导和刺激抑制的网络拓扑结构,然后研究感知交替期间的皮层微电路行为。
对象识别背后的神经机制
从一开始,双稳态感知就是我的两个主要研究兴趣之一。第二个是视觉对象表征、记忆和识别。许多想法和实验已经在之前的综述中进行了详细描述(Logothetis和Sheinberg,1996;Logothetis,1998;Gauthier 和 Logothetis,2000;Logothetis 2000)。在这里,我将选择性地引用一些有关颞下皮层生理学的里程碑式且被引用最多的论文。
视觉对象识别
LogothetisNK和Sheinberg, DL。(996)神经科学年度评论 10:577-621
在这篇综述中,我们考虑了来自心理学、神经心理学和神经生理学领域的证据,所有这些证据都支持存在多个识别系统的观点。来自正常成人、婴儿、动物和脑损伤患者的数据揭示了基本类别级别的对象分类和从同质对象类中识别单个对象之间的主要区别。用于视觉感知的对象表示和用于视觉引导运动的对象表示之间的额外区别提供了视觉识别系统多样性的进一步证据。此外,我们的心理物理学和神经生理学研究表明,一个系统可以通过多个视图或方面的组合来表示对象,而另一个系统可以通过结构基元及其空间相互关系来表示对象。
我们首先详细检查猕猴在分类和识别任务中的表现,开始了识别研究。经过大量的训练,动物学会了对一组高度相似的分心物进行个体识别,这项任务与识别特定面孔或特定鸟类的难题(所谓的“专家行为”)类似。人们发现,它们从已知观点归纳为新观点的能力几乎与人类专家相同。随后对靠近前内侧颞沟(AMTS)的下颞叶单个神经元进行的生理记录得到了一些有趣的结果(Logothetis和Sheinberg,1996)
猴子下颞叶皮层的形状表征
LogothetisNK、Pauls JM、Poggio T(1995)Current Biol 5:552-563
我们发现一组IT神经元对以前不熟悉的物体的视图有选择性地做出反应。细胞对物体的某一视图进行最大程度的放电,并且当物体旋转远离该首选视图时,它们的反应逐渐下降。从未遇到过对那些动物系统性地无法识别的视图有选择性反应的情况。大多数神经元在视平面旋转期间也表现出方向依赖性反应。一些神经元被发现围绕同一物体的两个视图进行调节,并且极少数细胞以视图不变的方式做出反应。对于在动物训练过程中广泛使用的五种不同物体,其行为表现变得与视图无关,发现多个细胞围绕同一物体的不同视图进行调节。一些视图选择单元对对象大小或其图像在中心凹内的位置的变化表现出反应不变性。
这些结果表明,由于对物体的辨别和识别进行了广泛的训练,IT神经元实际上可以形成复杂的感受野组织。这些物体对猴子来说没有任何先验意义,也不像猴子环境中熟悉的任何事物。简单的几何特征似乎无法解释神经元的选择性反应。这些发现有力地支持了这样的观点:一系列神经元——每个神经元都针对不同的物体方面进行调节,并且每个神经元都对图像变换表现出一定程度的不变性——作为一个整体,至少可以编码某些类型的复杂三维物体。在这样的系统中,对于任何给定的观察点,可能有几个神经元是活跃的,而单个单元则类似于单个视图有限邻域的模糊模板(Logothetis、Pauls等人,1994年, 洛格提斯和保罗 1995, Logothetis、Pauls等人,1995)。
在这一研究的延续中,我们测试了不同对象识别理论模型如何解释人类和猴子的专家行为,以及在训练和熟悉过程中猴子大脑中发生的情况(Sigala, Gabbiani等人,2002;Sigala和Logothetis,2002)。结果再次表明人类和猴子的识别策略之间存在重要的相似性。两个物种都没有将新刺激与类原型进行比较,或者根据刺激维度的条件概率做出决定。相反,他们根据每个对象与学习到的其他类别的熟悉成员的相似性,或者根据其与学习到的类别的线性边界之间的接近程度对其进行分类。
视觉分类塑造灵长类动物颞叶皮层的特征选择性
Sigala N, LogothetisNK(2002)Nature 415 :318-320
第一系列分类实验依赖于整体信息的处理。我们还对猴子进行了识别实验,训练它们对参数化刺激进行分类,例如脸部或鱼的线条图。每个示意性刺激由一个轮廓和四个可变特征组成,例如脸部绘图的眼睛高度、眼睛间距、鼻子长度和嘴巴高度。特征可以取三个离散值,并且类别可以在刺激的四个维度中的两个维度进行分离。例如,在脸部绘图中,诊断维度是眼睛的高度和间距。电生理记录显示 ITC中的神经元确实对诊断特征做出选择性反应(Sigala和Logothetis,2002)。显然,当刺激是复杂的对象或整个场景时,这种先验参数化不容易完成。自然图像包含许多空间尺度的结构,这些结构在整个图像上非均匀分布,因此它们是复杂、冗余视觉形式的典型例子。因此,我们通过在遮挡物后面呈现刺激来进一步识别诊断片段,即中灰色掩模被许多随机定位的窗口(“气泡”)刺穿,通过这些窗口可以看到被遮挡的图像。猴子继续对部分可见的图像执行辨别任务。他们是否能够识别部分可见的刺激取决于遮挡器是否揭示了对任务表现至关重要的图像部分。在MUA和LFP反应中都发现了诊断特征选择性,这再次表明这些特征在神经元的反应中被明确编码(Nielsen,Logothetis等人,2006;Nielsen,Logothetis等人,2006;Nielsen,Logothetis等人,2008)。然而,尽管MUA在测试的ITC部分均匀分布,但LFP仅在位于前面的记录位点具有选择性,这一发现表明诊断性首先在后IT皮层编码,并展示了结合电位和尖峰活动分析在映射大脑中的结构到计算功能中的力量。
猴子皮层的三维形状表征
Sereno, M. E., Trinath, T., Augath, M. A., & Logothetis, N. K. (2002). Neuron, 33(4), 635-652
 在麻醉或行为正常的猴子的fMRI实验中,也研究了猴子对形状和物体的表征。在一系列实验中,计算机生成的由阴影、随机点、结构元素或轮廓定义的3D对象以静态或动态(旋转)方式呈现。我们的研究结果表明,尽管在枕叶、颞叶、顶叶和额叶皮层广泛分布,但3D形状表征高度局部化,并且可能涉及与形状线索无关的常见大脑区域(Sereno,Trinath等,2002)。正在进行的研究检查了该网络在不同实验对象之间的特异性。
在麻醉或行为正常的猴子的fMRI实验中,也研究了猴子对形状和物体的表征。在一系列实验中,计算机生成的由阴影、随机点、结构元素或轮廓定义的3D对象以静态或动态(旋转)方式呈现。我们的研究结果表明,尽管在枕叶、颞叶、顶叶和额叶皮层广泛分布,但3D形状表征高度局部化,并且可能涉及与形状线索无关的常见大脑区域(Sereno,Trinath等,2002)。正在进行的研究检查了该网络在不同实验对象之间的特异性。
神经血管耦合
无论从直觉意义上还是从科学计算的角度来看,大脑都可以被认为是复杂的自适应系统。它们具有非常高的结构复杂性和巨大的连通性,两者都会根据经验而变化和发展。与传感器和效应器相关的信息以并行和分层的方式处理。不同层级之间的连接是双向的,其有效性由特定的关联和神经调节中心持续控制。
研究此类系统的一个主要困难是正确定义基本操作单元,因为任何此类模块都可以是复杂的系统,并且可以递归地分解为其他单元集。当在分布式大型系统的层面上解决问题时,例如潜在的知觉和认知(即我赶兴趣的研究能力),单个神经元(通常被认为是大脑的“明显”功能单元)几乎不能作为信息模块。
定位和理解我们知觉或认知能力背后的神经机制可能需要了解协同群体活动以及模块之间的局部和远程互连性。事实上,在复杂系统中,基本模块之间的关系可能比模块本身更重要。
我坚信,多模式方法对于研究大脑功能和功能障碍已变得完全不可或缺。在这种情况下,将MRI、PET和MEG等全局成像技术与侵入性方法相结合非常有帮助,使我们能够直接了解大脑的电活动。
我们需要了解微电路的组织,但我们也需要深入了解它们在广泛网络中的作用。输入、状态和脉络依赖的有效连接对于行为相关模式和传播反馈的出现至关重要。它对于多站点和多电极生理记录的规划和设计也至关重要。
上述简要描述解释了我在过去15年左右的时间里努力开发一种允许同时进行MR成像和电生理测量系统的动机。然而不幸的是,MRI只能测量替代信号,例如血流量、体积和氧合;这些代谢/血流动力学参数与潜在神经反应之间的确切关系在很大程度上仍然难以捉摸。因此,我很快发现自己有些偏离了我的主要目标,并提出了与神经血管耦合(NVC)机制相关的基本问题。当然,在尝试解释任何类型的激活图之前,我觉得我需要知道是什么导致了激活“块”。
为了解决与NVC相关的一些基本问题,我们修改并进一步开发了三个完整的扫描系统,目前允许同时进行功能磁共振成像和电生理学、神经药理学、质谱神经化学和电刺激。我们还开发了所有必要的硬件和软件,用于测量动物的眼睛,下颌和身体运动,并使用这些传感器信号来塑造和训练动物的行为。
为了将电生理学和功能磁共振成像结合起来,我们开发了整个干扰补偿系统,并将其应用在4.7T和两个7T磁体中。该系统通过测量和补偿由交替磁体梯度感应的所有电流来不间断地记录神经活动。
目前,多达15个通道可用于记录来自切向或径向分布的不同大脑部位的信号。为了对前颞区进行功能磁共振成像,我们还必须优化脉冲序列并开发多种不同类型的常规或植入式射频线圈,以实现0.1x0.1x0.6毫米尺度的分辨率。
总而言之,当我们开始“多模态方法”时,我们购买了“磁铁”及其控制台。每一个额外的硬件都是在实验室设计和构建的。所有这些技术成就已经许多技术期刊上发表,有时甚至在《Neuron》等高影响力期刊上发表。下面我总结了一些我认为为理解神经血管耦合(NVC)做出一定贡献的里程碑论文。
猴脑的功能成像
Logothetis NK, Guggenberger H, Peled S, Pauls J (1999) Nature Neuroscience 2: 555-62
 这是第一项针对麻醉和清醒的猴子进行的功能磁共振成像研究(Logothetis,Guggenberger等人,1999)。我们基于血氧水平依赖(BOLD)对比度呈现了猴子大脑皮层的空间高分辨率功能图像。
这是第一项针对麻醉和清醒的猴子进行的功能磁共振成像研究(Logothetis,Guggenberger等人,1999)。我们基于血氧水平依赖(BOLD)对比度呈现了猴子大脑皮层的空间高分辨率功能图像。
使用棋盘图案或灵长类动物图片,在4.7-特斯拉磁场中研究刺激引起的视觉皮层激活;我们使用优化的多切片、梯度回忆、平面回波成像(EPI)序列对整个大脑进行成像。在我们的麻醉方案下,视觉刺激产生了外侧膝状核(LGN)、初级视觉区域(V1)和多个纹外视觉区域(包括颞上沟区域)的强大、可重复的局部激活。在执行辨别任务时,清醒且行为表现良好的猴子也得到了类似的反应。
针对这项研究,有若干评论文章发表,例如Paradiso MA(1999):猴子研究构建通往人类大脑的桥梁。Nature Neuroscience 2: 491-492。
fMRI信号的基础神经生理学研究
LogothetisNK、Pauls JM、Augath MA、Trinath T、Oeltermann A(2001)Nature 412:150-157
这项研究首次展示了同时记录皮层内神经信号和功能磁共振成像反应(Logothetis、Pauls等人,2001)。我们将局部场电位(LFP)以及单个单元和多单元尖峰活动与猴子视觉皮层的高度时空分辨血氧水平依赖性(BOLD)fMRI响应进行了比较。在LFP中观察到最大幅度的变化,在记录位置表现为瞬态反应时,LFPs是唯一与血流反应显著相关的信号。逐项试验的线性系统分析表明,神经血管系统的脉冲响应既具有动物特异性又具有部位特异性,并且LFP比多单元响应能更好地估计BOLD反应。这些发现表明,BOLD对比机制反映了给定区域的输入和皮层内处理,而不是其尖峰输出。关于这项研究的评论和报道不计其数,包括Raichle ME(2001)的评论和报道;Charvy Narain(2006)《自然神经科学》的报道;以及Bandettini PA、Ungerleider LG(2001)和公共媒体的报道。迄今为止,该研究已被引用约1,800次。
负功能性MRI反应与猴子视觉区域V1神经元活动减少相关
Shmuel A、Augath MA、Oeltermann A、LogothetisNK(2006)Nat Neuro 9:569-577
这是第一个关于持续负BOLD反应(失活)神经机制的研究。通过同时进行功能性磁共振成像和电生理记录,我们在视觉皮层的刺激区域之外展示了与局部神经元活动减少相关的负BOLD反应(NBR),并且发现在V1最近的积极反应区域外7.15 ± 3.14毫米处。逐次试验的振幅波动揭示了NBR和神经元活动减少之间的紧密耦合。NBR与局部场电位和多单元活性的可比降低相关。我们的研究结果表明,NBR的相当一部分源于神经元活动的减少。
清醒猴子BOLD fMRI信号的神经生理学
Goense JBM, LogothetisNK(2008)Current Biol 18:631-640
上述研究提出一个重要问题,所报告的神经信号和血流动力学信号之间的相关性是否也适用于清醒的受试者。在这项研究中,我们训练猴子执行注视任务,同时使用每个记录位点的感受野内的刺激来引发神经反应,然后引发BOLD反应。我们首次用表现清醒的猴子证明,尽管LFP和MUA对BOLD反应有显著贡献,但LFPs是更好、更可靠BOLD信号预测因子。此外,当MUA反应适应但LFP保持不变时,BOLD信号保持不变。如果BOLD确实是主要由给定皮层区域的输入局部处理决定的,则不能反映电生理实验中报告的常见刺激或任务相关的典型神经元的活动(Goense和Logothetis,2008)。
血清素诱导的尖峰和突触周围活动分离对BOLD功能MRI的影响
Rauch A、Rainer G、LogothetisNK(2008)PNAS 105:6759-6764
这是第一项同时记录BOLD和电生理活动的研究,同时通过向麻醉猴的初级视觉皮层注射神经调节剂BP554来诱导MUA与LFP活动的分离。BP554是一种作用于5-HT1A受体的激动剂,主要通过钾诱导的超极化作用于传出神经元的膜。将其注入视觉皮层可靠地降低MUA,而不影响UP或BOLD活动。这一发现表明,与整体传入前突触和后突触处理相比,神经网络的传出相对较少产生代谢负担。
猕猴纹状体和纹外视觉皮层的微血管系统
Weber, B., Keller, A. L., Reichold, J., & Logothetis, N. K. (2008) Cerebral Cortex, 18(10), 2318-2330
本研究旨在阐述灵长类皮层微血管系统的特征,以便了解血管结构、密度以及区域和层次特异性变化对区域血流动态反应施加的限制。在猕猴视觉皮层中,应用了一系列解剖技术,包括腐蚀模型、免疫组织化学和细胞色素氧化酶(COX)染色。区域血管长度密度、体积分数和表面密度的详细测量揭示了不同视觉区域的血管化情况相似。虽然下皮层显示血管和细胞密度之间呈正相关,但这种关系在上层中非常弱化。从文献中获取的突触密度值也显示出与血管密度的适度相关性。然而, 血管密度与通过COX活性测量的稳态代谢需求密切相关。这一观察结果表明,尽管神经元和突触的数量决定了区域综合能力的上限,但其血管化反映了代表大脑稳态“默认”模式的那些亚群的神经活动(Weber, Keller等人2008年,Keller, Schüz等人2011年)。
血管密度与通过COX活性测量的稳态代谢需求密切相关。这一观察结果表明,尽管神经元和突触的数量决定了区域综合能力的上限,但其血管化反映了代表大脑稳态“默认”模式的那些亚群的神经活动(Weber, Keller等人2008年,Keller, Schüz等人2011年)。
体内连接
如上所述,体内连接可以提供有关在执行认知任务期间激活的大规模网络的拓扑结构和功能活动的宝贵信息。为了研究这种连接性,可以使用扩散张量成像(DTI)、锰增强MRI(MEMRI)以及直接电刺激和功能磁共振成像(DES-fMRI)等方法。所有这些技术都是非破坏性的,可用于研究可塑性、记忆形成和学习的纵向实验。DTI利用水的扩散各向异性,而MEMRI利用锰的跨神经元传递。我们的实验室中已经使用这种技术近10年,最近我们使用渗透泵和优化的注射方案,现在可以在大鼠和猴子身上重复使用该技术,而不会造成组织损伤。我们目前正在使用MEMRI来追踪神经调节和皮层-下皮层-皮层通路。
还可以使用DES-fMRI研究体内连接性。该技术允许研究许多不同的大规模相互作用,包括投射场的组织、局部突触可塑性变化的大规模效应以及由弥漫性上行系统引起的神经调节效应的时空分布。这种方法肯定具有转化价值,因为它允许研究支持认知的网络的功能性和病理性,并提供了电疗机制的洞察,有助于设计神经假体系统。在过去的6年里,我们为麻醉和行为动物开发并优化了DES-fMRI,并使用它来绘制皮质刺激期间的活动图以及研究ES诱导的信号传播以及LTP对海马体皮层连接的影响。
使用fMRI绘制电微刺激引起的猕猴皮层活动图
Tolias, A. S., Sultan, F. R., Augath, M. A., Oeltermann, A., Tehovnik, E. J., Schiller, P. H., & Logothetis, N. K. (2005) Neuron, 48(6)
在这项研究中,我们首先证明了该方法的可行性,随后我们展示了电微刺激的空间范围超出电流被动传播的预期范围,表明突触活动通过水平连接传播。在V1刺激期间,我们也观察到V2、V3、V4和MT/V5区域出现阳性BOLD反应,所有这些区域均与V1单突触连接。由于这些纹状体区域与V1形成反向连接,因此当然无法从功能磁共振成像确定观察到的纹状体活动是通过V1对这些区域的输入顺向驱动,还是通过它们对V1的投影的直接逆向激活驱动。然而,最重要的是,第一项研究未能揭示多突触激活(Tolias,Sultan等人,2005)。
电微刺激对皮层信号传播的影响
Logothetis NK, Augath MA, Murayama Y, Rauch A, Sultan FR, Goense JBM, et al.(2010) Nat Neuro 13:1283-1291.
为了进一步阐明上述观察结果,我们检查了猴子皮层传入刺激期间引起的皮层活动模式。我们发现,刺激外侧膝状核(LGN)的某个部位会增加初级视觉皮层(V1)接收来自该部位输入的区域的功能磁共振成像信号,但会抑制纹状体外皮层视网膜局部匹配区域的功能磁共振信号。与之前的观察结果一致,脑内记录表明,刺激脉冲后立即发生短暂的兴奋反应,随后是持久的抑制。在V1中显微注射GABA拮抗剂后,LGN刺激会在所有皮层区域诱导积极的fMRI信号。总而言之,我们的研究结果表明,电刺激通过抑制传入神经受到电刺激的任何新皮层区域的输出来扰乱皮层-皮层间信号传播。Clark、Armstrong和Moore(Clark、Armstrong等,2011年)指出,如果这一发现推广到所有皮层和皮层下刺激部位,它将对解释结果并推断先前大量实验中微刺激行为效应的可能神经基质产生重要影响。实际上,电刺激过程中生成的BOLD图可能会揭示丢失传入信号的区域,而不是投影场和涉及某些类型认知行为的区域。无论是直接通过DES还是间接通过经颅磁刺激(TMS)诱发的微刺激行为,可能反映了皮层-下皮层-皮层通路的处理,而不是直接的皮层-皮层间通讯。
方法论进步选集
中度高碳酸血症对麻醉非人灵长类动物神经活动的影响
Zappe AC、Uludag K、Oeltermann A、Ugurbil K、LogothetisNK(2008)Cereb Cortex 18:2666-2673
在这项研究中,我们在麻醉猕猴的视觉皮层中使用联合皮层内记录和功能磁共振成像,来探究用于“校准”BOLD信号的中度高碳酸血症是否真的能显著降低自发神经元活动。与预期一致,使用外源性造影剂测量脑血容量和BOLD信号表明,两者在高碳酸血症期间都会增加。与此相反,β和γ频率范围内的局部场电位的自发波动以及多单元活动减少了约10%。吸入6%CO2时为15%。吸入3% CO2时也发现神经元活动有强烈减少的趋势。这些发现表明CMRO2在高碳酸血症期间可能会减少,并且在应用高碳酸血症来校准BOLD信号时必须谨慎(Zappe、Uludag等人,2008)。
标记参数对非人灵长类动物基于灌注的fMRI的影响
Zappe, A. C.、Pfeuffer, J.、Merkle, H.、Logothetis, N. K.和Goense, J. B. M.(2008)CBFM, 28(3), 640-652。
 血氧水平依赖(BOLD)信号是目前最常用的功能磁共振成像(fMRI)模式。尽管易于实现,但它是一个模糊的信号,因为它是多种血流动力学因素综合作用的结果。功能性脑血流量变化,如使用动脉自旋标记(ASL)测量,通常发生在实质内,并且已经被证明比BOLD更紧密地与神经激活相关。然而,ASL技术本质上的低信号阻碍了其在fMRI基础研究中的广泛应用,在临床应用中更是如此。在这里,我们报告了首次在7T高磁场下在麻醉猕猴中实施连续ASL的研究。该技术经过优化,可在高空间分辨率下实现基于功能灌注的图像的最大信噪比。评估了标记时间和后标记延迟(PLD)等标记参数对视觉皮层功能性脑血流(fCBF)的影响。功能性脑血流图在2,000毫秒后并没有随着标记时间的增加而改变,这表明2,000毫秒的标记时间足以可靠地绘制fCBF。使用fCBF获得的百分比变化比使用BOLD获得的百分比更好地定位于灰质。与800ms的长PLD相比,200ms的短PLD显示皮层表面的fCBF变化明显更高,表明存在大血管污染。然而,PLD对fCBF的影响小于对基线CBF的影响。这些结果对于高分辨率应用以及需要准确量化猴子或人类研究时具有重要意义(Zappe、Reichold等人,2007;Zappe、Pfeuffer等人,2008)。
血氧水平依赖(BOLD)信号是目前最常用的功能磁共振成像(fMRI)模式。尽管易于实现,但它是一个模糊的信号,因为它是多种血流动力学因素综合作用的结果。功能性脑血流量变化,如使用动脉自旋标记(ASL)测量,通常发生在实质内,并且已经被证明比BOLD更紧密地与神经激活相关。然而,ASL技术本质上的低信号阻碍了其在fMRI基础研究中的广泛应用,在临床应用中更是如此。在这里,我们报告了首次在7T高磁场下在麻醉猕猴中实施连续ASL的研究。该技术经过优化,可在高空间分辨率下实现基于功能灌注的图像的最大信噪比。评估了标记时间和后标记延迟(PLD)等标记参数对视觉皮层功能性脑血流(fCBF)的影响。功能性脑血流图在2,000毫秒后并没有随着标记时间的增加而改变,这表明2,000毫秒的标记时间足以可靠地绘制fCBF。使用fCBF获得的百分比变化比使用BOLD获得的百分比更好地定位于灰质。与800ms的长PLD相比,200ms的短PLD显示皮层表面的fCBF变化明显更高,表明存在大血管污染。然而,PLD对fCBF的影响小于对基线CBF的影响。这些结果对于高分辨率应用以及需要准确量化猴子或人类研究时具有重要意义(Zappe、Reichold等人,2007;Zappe、Pfeuffer等人,2008)。
清醒猴子颞叶7T功能磁共振成像
Goense, J. B. M., Ku, S. P., Merkle, H., Tolias, A. S., & Logothetis, N. K. (2008). NeuroImage, 39(3), 1081-1093
 7T扫描仪越来越多地用于人类和非人类灵长类动物的功能磁共振成像,有望改善信噪比、空间分辨率和特异性。7T功能磁共振成像的一个缺点是耳道和鼻腔等充气腔体的磁化率伪影会导致信号丢失和失真。这限制了功能磁共振成像在这些区域的适用性,也限制了对跨越大规模皮层网络或整个大脑的过程的研究。我们的目标是研究清醒猴子的下颞叶(IT),因为它在物体感知和识别中具有重要作用,但功能信号会因磁化率梯度而降低。为了实现该区域的fMRI,我们优化了SE-EPI,它可以恢复GE-EPI丢失的信号,并且我们纠正了图像失真。SE-EPI(而非GE-EPI)还有一个额外的优点,即功能信号来自微血管系统,因此可以更好地代表神经激活。我们展示了清醒灵长类动物整个视觉通路的7T功能磁共振成像,在大脑的所有腹侧区域(包括耳道附近的区域)都变现成稳健而广泛的激活。这使得功能磁共振成像能够对通常受到伪影影响的区域进行功能磁共振成像,从而进行更可靠的全脑研究(Goense、Ku等人,2008; Ku, Tolias等人,2011)。
7T扫描仪越来越多地用于人类和非人类灵长类动物的功能磁共振成像,有望改善信噪比、空间分辨率和特异性。7T功能磁共振成像的一个缺点是耳道和鼻腔等充气腔体的磁化率伪影会导致信号丢失和失真。这限制了功能磁共振成像在这些区域的适用性,也限制了对跨越大规模皮层网络或整个大脑的过程的研究。我们的目标是研究清醒猴子的下颞叶(IT),因为它在物体感知和识别中具有重要作用,但功能信号会因磁化率梯度而降低。为了实现该区域的fMRI,我们优化了SE-EPI,它可以恢复GE-EPI丢失的信号,并且我们纠正了图像失真。SE-EPI(而非GE-EPI)还有一个额外的优点,即功能信号来自微血管系统,因此可以更好地代表神经激活。我们展示了清醒灵长类动物整个视觉通路的7T功能磁共振成像,在大脑的所有腹侧区域(包括耳道附近的区域)都变现成稳健而广泛的激活。这使得功能磁共振成像能够对通常受到伪影影响的区域进行功能磁共振成像,从而进行更可靠的全脑研究(Goense、Ku等人,2008; Ku, Tolias等人,2011)。
神经信号的解释
尖峰活动捕获单个神经元的输出。另一方面,局部场电位(LFP)捕获大量局部群体活动的集中突触活动和其他缓慢的方面。记录所有这些电生理信号以及fMRI BOLD信号为我们提供了前所未有的机会,以了解大脑如何整合单个神经元和广泛网络在不同空间和时间尺度上携带的所有信息。然而,由于缺乏能够比较和合并不同神经信号携带的不同类型信息的分析方法,以及缺乏如何实现信息整合的现实计算模型,理解神经群体如何处理信息的进展受到限制。在过去的8年里,我们开始开发数学分析和建模工具来解决这些问题。目前,Stefano Panzeri、我们的学生和我已就信号性质和传播的各个方面发表了18篇论文,还有4篇待发表论文,其中包括关于体积传导的研究,如(Belitski、 Gretton等人,2008; Mazzoni、Panzeri等人,2008;Montemurro、Rasch等人,2008; Kayser、Montemurro等人,2009; Belitski、Panzeri等人,2010;Besserve,Scholkopf等人。2010;Besserve、Scholkopf等人,2010)。
猴子皮层阻抗谱的体内测量:对信号传播的影响
Logothetis, N. K., Kayser, C., & Oeltermann, A. (2007). Neuron 55(5), 809-823
 为了结合从电场电位(LFP)和神经元尖峰活动(MILIA)获得的见解,我们需要更好地了解这些神经元活动指数的相对空间总和。与MUA相比,LFP具有更大的空间相干性,导致空间特异性和刺激选择性较低。据推测,低频和高频电信号的差异性传播导致了这一现象,这可能是由于皮层组织特异性衰减较高频率(即与频率相关的阻抗谱)而引起的。在这里,我们直接测量猴子初级视觉皮层体内的皮层阻抗谱。我们的结果表明,阻抗与频率无关,在灰质内是均匀且切线各向同性的,并且可以在假设纯电阻导体的情况下进行理论预测。我们认为LFP和MUA的空间总和是由这些信号发生器的大小及其背后的神经事件的性质决定的,而不仅仅由灰质的生物物理特性决定(Logothetis、Kayser等人,2007)。
为了结合从电场电位(LFP)和神经元尖峰活动(MILIA)获得的见解,我们需要更好地了解这些神经元活动指数的相对空间总和。与MUA相比,LFP具有更大的空间相干性,导致空间特异性和刺激选择性较低。据推测,低频和高频电信号的差异性传播导致了这一现象,这可能是由于皮层组织特异性衰减较高频率(即与频率相关的阻抗谱)而引起的。在这里,我们直接测量猴子初级视觉皮层体内的皮层阻抗谱。我们的结果表明,阻抗与频率无关,在灰质内是均匀且切线各向同性的,并且可以在假设纯电阻导体的情况下进行理论预测。我们认为LFP和MUA的空间总和是由这些信号发生器的大小及其背后的神经事件的性质决定的,而不仅仅由灰质的生物物理特性决定(Logothetis、Kayser等人,2007)。
猕猴大脑MRI和组织学联合图谱
Saleem, K. S., & Logothetis, N. K. (2006) Amsterdam, NY, Tokyo: Academic Press, Elsevier
 该图谱使用高分辨率磁共振(MR)图像和同一动物的相应组织学切片,绘制了猕猴大脑皮层和皮层下区域的详细构造细分。它参考了以前在猕猴中未曾报道过的MRI,呈现了对构造区域在水平切面上的详细绘图。图谱的第二部分使用相同的技术呈现冠状平面。第三部分可以快速识别水平、冠状和矢状 MR图像中的几个重要的皮层和皮层下区域(总共大约30个区域)。该图谱与其他任何可用图谱不同,因为它包含每个部分并将其与成像数据进行比较。这是一项重要的进步,因为该领域的绝大多数研究现在通常都使用功能磁共振成像图像(Saleem、Logothetis,2006)。
该图谱使用高分辨率磁共振(MR)图像和同一动物的相应组织学切片,绘制了猕猴大脑皮层和皮层下区域的详细构造细分。它参考了以前在猕猴中未曾报道过的MRI,呈现了对构造区域在水平切面上的详细绘图。图谱的第二部分使用相同的技术呈现冠状平面。第三部分可以快速识别水平、冠状和矢状 MR图像中的几个重要的皮层和皮层下区域(总共大约30个区域)。该图谱与其他任何可用图谱不同,因为它包含每个部分并将其与成像数据进行比较。这是一项重要的进步,因为该领域的绝大多数研究现在通常都使用功能磁共振成像图像(Saleem、Logothetis,2006)。
DBS(也用于患者)对大规模网络的影响的首次发现
我们的研究首先提供了大脑电导率的体内测量,随后绘制了电刺激对整个大脑的影响(Neuron和NatureNeuroscience发表论文)。虽然我的主要兴趣在于基础研究,但我非常清楚这一发现对于临床应用可能至关重要。例如,深部脑刺激(DBS)用于治疗帕金森病(PD)。德国是欧洲帕金森病流行病例数最多的国家,每10万居民中有150例,每10万名65岁以上居民有1,800例。DBS改变了数以万计的帕金森病患者的生活。然而,所有接受DBS治疗的患者中有40%经历了多种严重的不良事件,包括神经系统和精神疾病。部分问题源于微刺激方法仍然需要克服两个基本问题:(a)当我们使电流通过组织时,我们并不总是知道受到刺激的确切位置;(b)刺激会导致大量区域激活,甚至超出刺激部位,使得难以隔离和评估刺激区域本身的行为效应。我们开发的方法显示了微刺激过程中的一些潜在问题,目前正在与图宾根大学合作对其进行优化,以应用于人体深部脑刺激。
NET-fMRI在记忆巩固相关研究中的介绍和首次应用
多年来,在所报告的动物感知交替过程中,不同视觉区域的记录产生了新颖而有趣的发现,但在更大程度上,它们也表明了神经(感知)系统的复杂性,甚至可能是单个细胞或小细胞群的不足之处。我逐渐确信,行为研究与单个或多个单元记录的结合永远无法在系统级别提供可靠且可转换的信息。虽然此类研究对于了解有关单细胞和小群体的基本生理事实具有巨大价值,但它们未能解决系统行为概念。毫无疑问,这些方法仍然是不可或缺的,并且它们肯定会在未来很多年中得到应用,但我仍然觉得下一步对组件和网络并行研究的时机已经成熟。
经过几年的开发和优化,我们的方法允许采用一种我们称之为神经事件触发的功能磁共振成像(NETfMRI)的新方法,以便在生理上记录一个或多个结构中的神经事件,并将它们用于使用各种fMRI方法进行事件触发成像。例如,我们最近发表了一篇《自然》论文(2012年,目前已提交更多),其中记录了猴子在深度睡眠期间发生的海马快速振荡(波纹),并被认为是记忆巩固机制的一部分,并将它们用作事件来对齐和平均大脑激活的时间序列。
智能造影剂的合成
 最后但同样重要的是,我们现在已经为智能造影剂(SCA)的从头合成建立了良好的技术条件。这些分子的弛豫度是与有用离子或分子的浓度有关的功能,通常被称为靶标,例如神经递质或离子如钠和钙。术语“弛豫度”表示造影剂缩短附近水质子弛豫时间的能力。弛豫度越高,质子弛豫时间越短。尽管最初存在预期的困难,而且化学并不是我实验室的主要关注点,但我们已经能够使用钆或铕作为顺磁性离子合成和表征了30多种潜在的SCA。一些合成的SCA对pH敏感,另一些对Ca2+表现出显著的敏感性;后者的物理化学特性明显优于任何其他目前可用的Ca2+敏感MR探针。所有合成和表征结果现已发表在超过16种同行评审的化学期刊上,另外5篇论文目前正在评审中。我们已经在人工脑脊液、细胞外基质(ECM)以及最终在大脑中测试了合成的分子,目前我们正在通过实验和模拟扩散研究来研究这些试剂的生物分布和洗脱。同时脉冲序列,例如Look-locker方法经过优化和进一步开发,可将BOLD和流入效应与SCA弛豫度变化导致的实际强度变化分离开来(Mishra、Pfeuffer等人,2006;Mamedov、Mishra等人,2007;Angelovski、Fouskova等人,2008;Mishra,Fouskova等人,2008年,Mamedov,Taborsky等人,2009年,Angelovski、Chauvin等人,2010;Mamedov,Canals等人,2010年,Mamedov、Parac-Vogt等人,2010;Mishra、Dhingra等人,2010;Mishra、Schuez等人,2011)。
最后但同样重要的是,我们现在已经为智能造影剂(SCA)的从头合成建立了良好的技术条件。这些分子的弛豫度是与有用离子或分子的浓度有关的功能,通常被称为靶标,例如神经递质或离子如钠和钙。术语“弛豫度”表示造影剂缩短附近水质子弛豫时间的能力。弛豫度越高,质子弛豫时间越短。尽管最初存在预期的困难,而且化学并不是我实验室的主要关注点,但我们已经能够使用钆或铕作为顺磁性离子合成和表征了30多种潜在的SCA。一些合成的SCA对pH敏感,另一些对Ca2+表现出显著的敏感性;后者的物理化学特性明显优于任何其他目前可用的Ca2+敏感MR探针。所有合成和表征结果现已发表在超过16种同行评审的化学期刊上,另外5篇论文目前正在评审中。我们已经在人工脑脊液、细胞外基质(ECM)以及最终在大脑中测试了合成的分子,目前我们正在通过实验和模拟扩散研究来研究这些试剂的生物分布和洗脱。同时脉冲序列,例如Look-locker方法经过优化和进一步开发,可将BOLD和流入效应与SCA弛豫度变化导致的实际强度变化分离开来(Mishra、Pfeuffer等人,2006;Mamedov、Mishra等人,2007;Angelovski、Fouskova等人,2008;Mishra,Fouskova等人,2008年,Mamedov,Taborsky等人,2009年,Angelovski、Chauvin等人,2010;Mamedov,Canals等人,2010年,Mamedov、Parac-Vogt等人,2010;Mishra、Dhingra等人,2010;Mishra、Schuez等人,2011)。
精选综述
使用功能磁共振成像能做什么以及不能做什么
Logothetis NK (2008). Nature 453:869-878.
功能磁共振成像(fMRI)目前是认知神经科学中的主要神经影像学技术。扫描仪技术、图像采集协议、实验设计和分析方法的进步有望推动功能磁共振成像从单纯的制图到真正的大脑组织研究。然而,关于功能磁共振成像数据解释的许多基本问题仍然存在,因为得出的结论往往忽略了该方法的实际局限性。在这里,我概述了功能磁共振成像的现状,并利用神经影像和生理数据来展示我们目前对血流动力学信号的理解及其对神经影像数据解释的限制。
视觉竞争
Blake R,LogothetisNK(2002)Nature Reviews Neuroscience 3:13-23。
“最新证据支持将竞争视为一系列过程的观点,每个过程都是由视觉层次结构不同水平上的神经机制实现。尽管仍然存在未解答的问题,但这种竞争观点可能使我们能够解决其研究中出现的一些争议和明显的矛盾。
 与主导刺激相关的视觉信息在整个视觉通路中不间断地流动,触发反馈连接的正常复合体,并与那些信号视觉对象或事件语义和情感内涵的所有过程建立神经联系。无论注意力如何影响视觉场景的感知,它同样也会影响对主导刺激的感知。然而,对于被抑制的刺激,情况并非如此。VER、功能磁共振成像、脑磁图和单个单元研究均表明,在竞争的抑制阶段,神经处理中存在强大的干扰。尽管一些争议问题仍有待解决,但新兴观点认为竞争涉及多个分布式过程,为调和竞争文献中的冲突提供了一种非常有希望的方法。” (Blake和Logothetis,2002)。
与主导刺激相关的视觉信息在整个视觉通路中不间断地流动,触发反馈连接的正常复合体,并与那些信号视觉对象或事件语义和情感内涵的所有过程建立神经联系。无论注意力如何影响视觉场景的感知,它同样也会影响对主导刺激的感知。然而,对于被抑制的刺激,情况并非如此。VER、功能磁共振成像、脑磁图和单个单元研究均表明,在竞争的抑制阶段,神经处理中存在强大的干扰。尽管一些争议问题仍有待解决,但新兴观点认为竞争涉及多个分布式过程,为调和竞争文献中的冲突提供了一种非常有希望的方法。” (Blake和Logothetis,2002)。
我们关于竞争的研究成果也多次发表在《科学美国人》杂志上(1999年、2006年)和其他《科学美国人》书籍和章节中,并且获悉已被翻译成30多种语言。2006年的文章开篇这样写道:“在寻找心灵的过程中,科学家们聚焦于视觉感知——即我们如何解释我们所看到的事物。”(Logothetis,1999)。
fMRI及其解释:V5/MT区域方向选择性的说明
Bartels, A., Logothetis, N. K., & Moutoussis, K. (2008) Trends in Neurosciences, 31(9), 444-453.
 功能磁共振成像是一种非侵入性研究大脑功能的工具。它可以可靠地识别给定任务的神经参与部位。然而,fMRI信号在多大程度上可以与电生理学测量结果相关联?血氧水平依赖信号是否可以解释为空间汇集的尖峰活动?在这里,我们结合神经血管耦合、功能成像和神经生理学的知识来讨论 fMRI是否成功地证明了视觉大脑中最成熟的功能特性之一,即运动处理区域 V5/MT+的方向选择性。我们还讨论了功能磁共振成像和电生理学在对不同生理过程敏感性方面的差异。我们的结论是,功能磁共振成像是侵入性技术的补充,而不是低分辨率的替代品,并且它应该被解释为一种独立信号。
功能磁共振成像是一种非侵入性研究大脑功能的工具。它可以可靠地识别给定任务的神经参与部位。然而,fMRI信号在多大程度上可以与电生理学测量结果相关联?血氧水平依赖信号是否可以解释为空间汇集的尖峰活动?在这里,我们结合神经血管耦合、功能成像和神经生理学的知识来讨论 fMRI是否成功地证明了视觉大脑中最成熟的功能特性之一,即运动处理区域 V5/MT+的方向选择性。我们还讨论了功能磁共振成像和电生理学在对不同生理过程敏感性方面的差异。我们的结论是,功能磁共振成像是侵入性技术的补充,而不是低分辨率的替代品,并且它应该被解释为一种独立信号。
最后但同样重要的是,我在这里加入了两篇具有代表性的综述,主要是因为它们代表了我个人的科学思维方式,其中之一与神经血管耦合有关,另一篇涉及对新方法的机会主义性使用。
参考文献
Blake, R. and N. K. Logothetis (2002). "Visual competition." Nature Reviews Neuroscience3(1): 13-23.
Blake, R. R. (1989). "A Neural Theory of Binocular Rivalry." Psychological Review96: 145-167.
Logothetis, N. K. (1990). "Subjective Perception - Reply." Science Magazine247(4943): 727.
Logothetis, N. K. (1999). Vision: A window on consciousness. Scientific American. 281: 68-75.